KEKUATAN ASAM DAN BASA DALAM KIMIA ORGANIK
Asam
Organik
Asam organik dapat diartikan dengan
senyawa yang punya derajat keasaman, atau dapat diartikan dengan suatu senyawa
yang mempunyai gugus karboksil. Ada beberapa senyawa asam organik yang mungkin
umum ditemui atau dikenali seperti pada table brikut ini :

Asam
organik sering dikatakan asam lemah, kenapa hal itu bisa terjadi? Karena asam
organik terionisasi tidak sempurna atau tidak lengkap. pada keadaan tertentu
atau pada suatu waktu senyawa asam berada didalam larutan tidak terionisasi. Salah
satu contoh terdapat pada kasus asam etanoik dimana larutan yang terkandung 99%
molekul asam etanoik hanya 1% yang terionisasi, hal ini menyebabkan
kesetimbangan bergeser kearah kiri.
Membandingkan
kekuatan asam khusunya asam lemah biasanya dilihat dari besar kecilnya nilai
PKa semakin kecil nilai PKa maka semakin tinggi tingkat keasamannya.

Ada
faktor-faktor yang mempengaruhi ionisasi asam diantaranya sebagai berikut :
1. Kekuatan
dari ikatan yang diputuskan.
2. Kestabilan
ion yang terbentuk
Faktor
yang paling penting dalam menentukan kekuatan relatif dari molekul adalah pada
sifat dari ion ion yang terbentuk. selalu
mendapatkan ion hidroksinium jadi kita tidak perlu membandingkan itu. Yang
perlu kita bandingkan adalah sifat dari anion (ion negatif) yang berbeda-beda
pada setiap kasus.
Kita
akan coba membandingkan tingkat keasaman beberapa senyawa asam organik.
Fenol dan Asam Etanoat
 |
| fenol |
 |
| asam asetat/ asam etanoat |
Fenol
mempunyai –OH terikat pada cincin benzennya.
Saat
ikatan hidrogen-oksigen pada fenol terputus, anda mendapatkan ion fenoksida , C6H5O–.
Delokalisai juga terjadi pada ion ini. Pada saat ini, salah satu dari antara
elektron bebas dari atom oksigen overlap dengan elektron dari rantai benzen.
Overlap ini mengakibatkan
dislokalisasi. Dan sebagai hasil muatan negatif tidak hanya berada pada oksigen
tetapi tersebar ke seluruh molekul.
Lalu mengapa fenol lebih lemah
daripada asam etanoat? Pada ion etanoat, delokalisasi terpusat pada daerah
antara 2 atom oksigen. Sistem yang terdelokalisasi membagi muatan negatif
diantara kedua atom oksigen. Tidak ada oksigen yang lebih kuat menarik hidrogen
ion.
Pada ion fenoksida, atom oksigen
tunggal masih merupakan yang paling elektronegatif dan sistem yang
terdelokalisasi terpusat pada daerah oksigen tersebut. Sehingga atom oksigen
memiliki muatan yang paling negatif, walaupun sebenarnya tidak memiliki muatan
sebanyak itu apabila delokalisasi tidak terjadi.
Delokalisasi membuat ion fenoksida
lebih stabil dari seharusnya sehingga fenol menjadi asam. Namun delokalisasi
belum membagi muatan dengan efektif. Muatan negatif disekitar oksigen akan
tertarik pada ion hidrogen dam membuat lebih mudah terbentuknya fenol kembali.
Sehingga itu fenol merupakan asam yang sangat lemah.
Fenol mempunyai manfaat sebagai anti septik yang sering diperdagangkan, dan digunakan salah satunya sebagai pembasmi rumput.
Sedangkan asam etanoat atau yang kita kenal dengan asam asetat atau asam cuka sering digunakan sebagai pemberi rasa asam pada makanan dan sebagai penambah aroma pada makanan. Asam asetat dapat ditolerir oleh tubuh manusia karena mempunyai pH 4,76. namun demikian asam asetat pekat masih bersifat korosif jika dikonsumsi berlebihan didalam tubuh. perlu diketahui bahwasannya manusia yang baru lahir mempunyai pH 8,0 sedangkan penderita sakit keras seperti kanker umumnya mempunyai pH 3,5 kebawah. manusia dapat mentolerir asam didalam tubuh tubuh jika masih diatas 4 jika sudah dibawah 4 maka perlu penanganan medis. pH yang sehat atau yang optimal pada manusia dianara rentang 7,0 - 7,5.
Fenol mempunyai manfaat sebagai anti septik yang sering diperdagangkan, dan digunakan salah satunya sebagai pembasmi rumput.
Sedangkan asam etanoat atau yang kita kenal dengan asam asetat atau asam cuka sering digunakan sebagai pemberi rasa asam pada makanan dan sebagai penambah aroma pada makanan. Asam asetat dapat ditolerir oleh tubuh manusia karena mempunyai pH 4,76. namun demikian asam asetat pekat masih bersifat korosif jika dikonsumsi berlebihan didalam tubuh. perlu diketahui bahwasannya manusia yang baru lahir mempunyai pH 8,0 sedangkan penderita sakit keras seperti kanker umumnya mempunyai pH 3,5 kebawah. manusia dapat mentolerir asam didalam tubuh tubuh jika masih diatas 4 jika sudah dibawah 4 maka perlu penanganan medis. pH yang sehat atau yang optimal pada manusia dianara rentang 7,0 - 7,5.
Etanol
 |
| Etanol |
Etanol, CH3CH2OH, merupakan asam yang sangat lemah sampai sampai-sampai anda bisa menganggapnya bukan sebagai asam. Jika ikatan oksigen dan hidrogen terputus dan melepaskan ion, ion etokside terbentuk.
Tidak
ada cara untuk mendelokalisasi ikatan negatif yang terikat kuat dengan atom
oksigen. Muatan negatif tersebut akan sangat menarik atom hidrogen dan etanol
akan dengan mudah terbentuk kembali.
Etanol mempunyai manfaat biasanya digunakan sebagai pelarut kimia karena mudah menguap, maka deari itu sering digunakan sebagai pelarut dalam pratikum di labor.
Etanol mempunyai manfaat biasanya digunakan sebagai pelarut kimia karena mudah menguap, maka deari itu sering digunakan sebagai pelarut dalam pratikum di labor.
Basa Organik
Basa organik
biasanya dicirikan dengan adanya atom dengan pasangan elektron yang bebas dan
dapat mengikat proton. Senya senyawa yang mengandung atom nitrogen adalah salah
satu contoh dari basa organik. Tetapi hal
lainnya senyawa yang mengandung oksigen dapat bertindak sebagai basa jika
direaksikan dengan asam yang cukup kuat.
Dalam
membandingkan tingkat kebasaan suau basa lemah hanya dengan melihat atau
membandingkan nlai PKb nya, semakin kecil PKb maka semakin basa senyawa itu
atau semakin kuat basanya.
Ada
dua faktor yang mempengaruhi kekuatan dari sebuah basa adalah :
- Kemudahan pasangan bebas mengikat ion hydrogen.
- kestabilan dari ion yang terbentuk.
Sebagai
contoh kita coba bandingkan tingkat kebasaan metilamin alifatik dan amoniak.
Metilamin dan
Amoniak
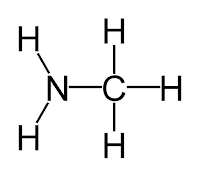 |
| Metilamin |
 |
| Amoniak |
Perbedaannya dengan amonia hanyalah adanya CH3 pada metil amin. Golongan alkil memiliki kecenderungan untuk mendoron elektron menjauh dari mereka. Ini berarti akan adanya sejumlah muatan negatif tambahan disekitar atom nitrogen. Muatan negatif tambahan tersebut membuat pasangan bebas lebih menarik atom hidrogen.
Semakin
negatif nitrogen semakin mudah terikatnya ion hidrogen.
Lalu
bagaimana dengan saat ion metil telah terbentuk, apakah ini lebih stabil
daripada ion amonium?
Bandingkan
ion metilamonium dengan ion amonium.
Pada
ion metilamonium, muatan positif tersebar disekitar ion dari efek “dorongan
elektron” metil. Semakin anda menyebar muatan tersebut, semakin stabil sebuah
ion. Namun pada ion amonium tidak ada cara untuk menyebarkan ion positif.
Ringkasan:
1. Nitrogen lebih negatif di metilamin daripada di amonia,
sehingga mengikat hidrogen lebih aktif.
2. Ion yang terbentuk di metilamin lebih stabil dari ion yang
terbentuk dari amonia, sehingga lebih sulit berubah ke bentuk ion hidrogen
lagi..
Kesimpulan:
metilamin merupakan basa yang lebih kuat dari amonia.
Amoniak digunakan sebagai campuran bahan obat obatan dan pupuk urea yang biasanya dijumpai dalam kehidupan sehari-hari. sedangkan amina banyak digunakan sebagai pewarna, seperti yang sering kita jumpai di praikum misal metil orange, dan sebagai bahan pembuat obat-obatan.
Amoniak digunakan sebagai campuran bahan obat obatan dan pupuk urea yang biasanya dijumpai dalam kehidupan sehari-hari. sedangkan amina banyak digunakan sebagai pewarna, seperti yang sering kita jumpai di praikum misal metil orange, dan sebagai bahan pembuat obat-obatan.
Permasalahan
:
1. Asam maleat dan asam fumarat
mempunyai jumlah molekul yang sama, namun
posisinya yang berbeda seperti pada gambar dibawah ini
Dari struktur diatas mana yang
mempunyai tingkat keasaman lebih tinggi? Jelaskan !
2. Asam
asetat merupakan salah satu asam karboksilat yang paling sederhana setelah asam
format. Larutan asam asetat dslam air merupakan sebuah asam lemah, karena hanya
terdisosiasi sebagian menjadi ion H+ dan CH3COO-, kenapa hal itu bisa terjadi ?
3. Delokalisasi
dari muatan negatif asam karboksilat yang menyebabkan asam karoksilat lebih
asam dibandingkan dengan fenol, jelaskan mengapa hal itu bisa terjadi?




Saya akan menjawab permasalahan nomor 3. Di sini, fenol terdelokalisasi yang membuat ion fenoksida lebih stabil dari seharusnya sehingga fenol menjadi asam. Muatan negatif yang ada disekitar oksigen akan tertarik pada ion hidrogen dam membuat lebih mudah terbentuknya fenol kembali.
BalasHapus1. Asam maleat lebih tinggi dari pada asam fumarat karena Asam maleat dapat membentuk ikatan hidrogen intramolekuler, hal ini dapat menyebabkan keasaman dari asam maleat lebih tinggi dari asam fumarat serta kelarutan dalam air yang berhubungan dengan kepolaran asam maleat lebih tinggi dari asam
BalasHapusfumarat
Semoga membantu:)
2. Hal ini dikarenakan kurangnya stabilisasi hidrasi dan tidak meningkatnya entropi, maka kesetimbangan antara ion yang terbentuk dengan molekul tidak dapat terdisosiasi
BalasHapus